Materiales metálicos
Hay muchas formas de clasificar los materiales:- según su composición, por su origen, de acuerdo con sus propiedades físico- químicas, desde el punto de vista de la fabricación, etc..
- Según su origen, los materiales se pueden clasificar en materiales naturales y materiales artificiales, dependiendo de que se encuentren directamente en el medio natural o sean el resultado de algún proceso de fabricación. Por ejemplo, el granito es un material natural, mientras que el acero es un material artificial.
- Según sus tipos, los materiales se pueden clasificar en elementos y compuestos,
homogéneos y heterogéneos, metálicos y no metálicos, inorgánicos y orgánicos, etc.
- Según sus propiedades, los materiales se pueden clasificar en rígidos y flexibles,
tenaces y frágiles, conductores y aislantes, reciclables y no reciclables, etc.
En este caso, a continuación, voy a hablar de los materiales metálicos.
Clasificación
estructuras ligeras que sustituyan en un futuro al acero en muchas partes del vehículo.
- Magnesio: Las estructuras de magnesio podrían ahorrar un 15% del peso del coche.
- Consumo: El menor peso podría conllevar una rebaja de un 9 a un 12% en el consumo de combustible.
- Corrosión: Un nuevo proceso de producción evita los problemas de corrosión del magnesio.
2020: En 2020 se espera que el magnesio ayude a reducir en más de 100 kg el peso de los coches.
2.- Enlace metálico
El enlace metálico es el que mantiene unidos los átomos de los metales.
Propiedades físicas.
Propiedades químicas.
Estructura cúbica centrada en las caras Está constituida por un átomo en cada vértice y un átomo en cada cara del cubo. Los metales que cristalizan en esta estructura son: hierro gama, cobre, plata, platino, oro, plomo y níquel.
Cada átomo está rodeado por doce átomos adyacentes y los átomos de las caras están en contacto.
Esta estructura está determinada por un átomo en cada uno de los vértices de un prisma hexagonal, un átomo en las bases del prisma y tres átomos dentro de la celda unitaria.
Cada átomo está rodeado por doce átomos y estos están en contacto según los lados de los hexágonos bases del prisma hexagonal.
Los metales que cristalizan en esta forma de estructura son: titanio, magnesio, cinc, berilio, cobalto, circonio y cadmio.
Algunos metales sufren cambio de estructura a diferentes temperaturas como el hierro que se presenta como cúbico centrado a temperatura normal pero cambia a centrado en las caras a 912°C y vuelve a ser cúbico centrado a 1400°C; cuando un metal cambia su estructura de esta manera se dice que es alotrópico
Antiguamente no se conocían los metales. Cuando se descubrieron y se aprendió a trabajarlos cambió la vida de los pueblos. La historia de los metales se inició hace cerca de nueve mil años en el Próximo Oriente. El primer metal utilizado fue el cobre; en Palestina y Anatolia los antiguos pobladores martillaron trozos de cobre nativo para formar herramientas. En los siguientes siglos se aprendió a extraer cobre de los minerales y mezclarlo con estaño para formar bronce.
El bronce le permitió a los imperios de la antigüedad producir armas para los ejércitos de conquista. La agricultura y la artesanía tuvieron herramientas fuertes y la producción creció. Desde entonces los metales sirvieron para muchos fines. El oro y la plata adornaron a los grandes personajes y los acompañaron en sus sepulcros. El culto religioso se sirvió de ellos para elaborar ornamentos y símbolos.
El 1000 antes de Cristo casi todos los pueblos del Viejo Mundo tenían metales; desde el Mediterráneo, pasando por Persia e India, se hicieron en bronce y oro armas, instrumentos y adornos variados. Desde China la metalurgia se extendió a Japón, en donde los aceros armaron a los samuráis, y también al sureste asiático cuyos templos se coronaron con cúpulas doradas.
Para la época en que cayó el Imperio Romano los implementos de metal eran parte de la vida diaria. Ya no se podía entender el comercio sin la moneda ni las actividades cotidianas sin herramientas metálicas. Las religiones del mundo antiguo en Asia, África y Europa, recurrieron al oro y la plata para forjar los objetos sagrados. En el convulsionado mundo medieval chocaron en la guerra los metales de Occidente y los de Oriente.
Desde 1300 los estados del occidente de África, al sur del Sahara, usaron el bronce para decorar las ciudadelas reales. Para surtir de materias primas a los herreros y distribuir sus productos se organizaron caravanas que cruzaban el desierto. Los orfebres africanos se convirtieron en maestros de la fundición; los adornos y delicadas miniaturas comunican una profunda simbología.
Los antiguos suramericanos empezaron a trabajar el cobre y el oro alrededor de 1500 antes de Cristo. Unos mil años más tarde varias culturas andinas adornaban a sus líderes con suntuosos atuendos. El oro y la plata se reservaron para los gobernantes y la religión; los objetos rituales y simbólicos comunicaban una visión del mundo que compartía toda la sociedad.
La metalurgia en la Colombia prehispánica fue, ante todo, orfebrería. En dos mil años surgieron muchos estilos diferentes y se fabricaron miles de piezas para el ritual y la ofrenda. Los indígenas manejaron con maestría el oro, el cobre, la tumbaga y el platino. La conquista europea, en 1500, truncó este desarrollo y causó la desaparición de la producción orfebre.
En los últimos 300 años la producción de metales ha tenido un gran avance. La gran industria usa millones de toneladas de metales cada año; también las sociedades no industriales consumen cada vez más metales para los más variados propósitos. La historia de la humanidad en los últimos nueve mil años es la historia de los metales: con ellos hemos construido el mundo en que vivimos.
La metalurgia tiene por objeto la extracción de los minerales por una serie de medios y procedimientos(que puede ser, en la superficie de la tierra, o en yacimiento bajo la superficie),
para lograr su transformación en productos útiles para la aplicación industrial. Antiguamente se podía considerar la metalurgia como un arte, del cual se transmitían de generación en generación los conocimientos empíricos y procedimientos considerados secretos para la obtención del cobre, del hierro y en especial del acero, atribuyéndose a fórmulas secretas la obtención de un buen producto. La capacidad personal del operario era un factor decisivo. No hace mucho que la metalurgia se basa en amplios conceptos científicos cada vez más desarrollados y eficaces. Se ha demostrado que los procedimientos de extracción pueden ser muy variados, pero lógicamente el dato importante que ha de acompañar a la calidad es el costo de extracción,
siendo entonces solamente los métodos que aseguran un mayor beneficio dentro del menor costo, los que la industria aplica como más convenientes.
Muy raramente se encuentran metales en estado de pureza como para ser empleados industrialmente, pero con frecuencia se los halla en la mina combinados con otros cuerpo de composición muy variada y de éstos, los más comunes son: los óxidos, sulfuros, carbonatos, silicatos, sulfatos y los fosfatos.
Para obtener los metales debe efectuarse una serie de operaciones que consisten en extraer cuerpos extraños perjudiciales, llamados ganga, y graduar los que pueden contribuir a determinada propiedad particular. Para ello se los somete a la trituración, lavado, calcinación, fusión y afinación.
Trituración
Consiste en fragmentar el metal en trozos de diversos tamaños, por medio de machacadoras
mecánicas a mandíbula, molinos, etc.
Lavado
Tiene por objeto la separación de los minerales por medio del agua en movimiento, con lo cual y de acuerdo con sus densidades, se depositan en el fondo o son arrastrados por las aguas. Este proceso es ayudado con mesas y cajas con cernidores de gran tamaño.
Molienda
El material extraído es nuevamente triturado y luego molido, obteniéndose así unos trocitos no mayores a 25 mm. A partir de allí, pasa a la denominada molienda húmeda, donde llega al tamaño menor de 1 mm siendo luego llevado a un separador magnético donde se adhiere la magnetita, rica en hierro y se elimina el resto.
Llevada la magnetita al molino de bolas, en circuito cerrado con clasificadores de hidrociclones, es reducida al tamaño de 44 micrones y que al hacerla pasar por seis separadores magnéticos, sucesivamente, se llega a obtener el 69% de hierro y un mínimo de 0.25% de fósforo. Este último puede ser reducido al 0.15% mediante flotación espumosa.
Para obtener los pellets la magnetita es introducida en tambores, donde se le adiciona un porcentaje de bentonita, como aglomerante, estos pellets, en forma de bolitas, son llevados a los hornos verticales donde son endurecidas a una temperatura de 1300° C. En este estado se los lleva a los altos hornos para la producción del arrabio.Teniendo en cuenta que la tecnología ha desarrollado procesos de reducción directa que eliminan el uso del alto horno, se está estudiando la aplicación de este nuevo procedimiento a una parte de la producción de pellets, así como también se prevee la posibilidad de producir aceros en la zona.
Calcinación
Se emplea para eliminar a baja temperatura los productos volátiles que no pueden ser separados con la trituración ni el lavado, para aumentar la porosidad y desecarlos. Este proceso es útil cuando los minerales deben ser transportados a los hornos a grande distancias, pues disminuye los gastos de transporte. Con el empleo de los grandes hornos, esta operación no es necesaria, ya que se verifica en su parte superior.
Fusión
Consiste en llevar el mineral a la temperatura de fusión, para que licuado permita extraer los
cuerpos que aún no se hubiera podido separar; éstos por su menor densidad sobrenadan el metal fundido y por medios adecuados se los extrae. Para ayudar a la fusión se emplean elementos auxiliares llamados fundentes, que al combinarse con la materia terrosa forma una escoria flúida a la temperatura de funcionamiento del horno (1900° C) y que puede así ser separada del metal fundido. La naturaleza del fundente depende de la ganga (material terroso que acompaña al mineral en la mena), si es ácida (silícea o aluminosa) se emplea el carbonato de calcio o fosfato de calcio; en cambio, si es básica, se le agrega arcilla, pizarra arcillosa o arenisca. El fundente debe ser agregado al mineral antes de ser introducidos en los hornos.
Afinación
Después de la fusión, hay ciertos metales como el cobre y el plomo, de los cuales aún no ha sido posible extraer toda la ganga. Se procede a fundirlos repetidas veces o a comprimirlos, proceso que denominado de afinación. Para la separación de la ganga del metal también se ha empleado el método de flotación, que consiste en introducir el mineral en recipientes de agua con un reactivo químico espumante. El mineral flota en la espuma y la ganga terrosa se moja y se sumerge, extrayéndose entonces de la parte superficial las partículas metalíferas. Este procedimiento es interesante por cuanto permite extraer metales de las menas en las que éste es escaso.
Cada día en todo el mundo, el ser humano genera millones de toneladas de basura. Sin
embargo, muchos de estos desperdicios se reciclan y vuelven a estar de nuevo en las estanterías de los supermercados. Algunos de estos residuos son los metales, que representan el 10% de los desperdicios que producimos a diario. Pero, ¿qué, cómo y dónde podemos reciclar los metales?
Sin embargo, estos metales no siguen un patrón común a la hora de reciclarse. De ahí que sea importante separar el aluminio de aquellos materiales ferrosos como el hierro y el acero, ya que en muchos centros de reciclaje no se aceptan ambos tipos. Se pueden diferenciar de diversas maneras. La más fácil es a través de la etiqueta identificadora que la gran mayoría de los productos poseen. En caso de no tener dicha información, se podrá recurrir a un remedio más casero, como el de coger un imán. Todos aquellos materiales
que no se peguen querrán decir que son de aluminio.
Normalmente, en todas los países existen servicios y empresas de reciclaje que se encargan de su respectivo procesamiento. En estos lugares se informarán sobre los metales que se aceptan, así como de otras reglas a tener en cuenta para que su reciclaje sea óptimo. En otras ocasiones, existen también políticas locales, las cuales impulsan al ciudadano a comenzar a reciclar desde su propio hogar, recomendando la clasificación de basuras para depositarlas en cubos específicos.
Una vez que se sabe dónde, el siguiente paso será conocer cuáles son los materiales que podemos reciclar.
El acero
El acero, uno de los metales más utilizado en el mundo y también uno de los que más se han reciclado desde la antigüedad, se encuentra en nuestra vida cotidiana en muchos productos, como latas de comida, frigoríficos, motores o clavos. De hecho, el 40 por ciento de la chatarra de acero se destina a la producción de nuevos aceros, aunque sólo un pequeño porcentaje puede reciclarse como acero de envases. Cada envase producido contiene, aproximadamente, un 25 por ciento de acero reciclado.
En este sentido, si se recicla constantemente acero, se podrá no sólo aliviar la demanda de la minería, sino también ahorrar los recursos empleados en su producción, los cuales representan el cuádruple de gastos de energía y materia prima. Y es que, según estudios realizados en 2006, la chatarra reciclada disminuyó hasta el 40 por ciento de las necesidades mundiales de acero.
La corrosión se define como el deterioro de un material a consecuencia de un ataque electroquímico por su entorno. De manera más general, puede entenderse como la tendencia
general que tienen los materiales a buscar su forma más estable o de menor energía interna. Siempre que la corrosión esté originada por una reacción electroquímica (oxidación), la velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, de la salinidad del fluido en contacto con el metal y de las propiedades de los metales en cuestión. Otros materiales no metálicos también sufren corrosión mediante otros mecanismos.
Sin embargo, la corrosión es un fenómeno mucho más amplio que afecta a todos los materiales (metales, cerámicas, polímeros, etc.) y todos los ambientes (medios acuosos, atmósfera, alta temperatura, etc.).
Es un problema industrial importante, pues puede causar accidentes (ruptura de una pieza) y, además, representa un costo importante, ya que se calcula que cada pocos segundos se disuelve 5 toneladas de acero en el mundo, procedentes de unos cuantos nanómetros, invisibles en cada pieza pero que, multiplicados por la cantidad de acero que existe en el mundo, constituyen una cantidad importante.
Tipos de corrosión
Existen muchos mecanismos por los cuales se verifica la corrosión, que tal como se ha explicado anteriormente es fundamentalmente un proceso electroquímico.
Corrosión electroquímica o polarizada
La corrosión electroquímica se establece cuando en una misma superficie metálica ocurre una diferencia de potencial en zonas muy próximas entre sí en donde se establece una migración electrónica desde aquella en que se verifica el potencial de oxidación más elevado, llamado área anódica hacia aquella donde se verifica el potencial de oxidación (este término ha quedado obsoleto, actualmente se estipula como potencial de reducción) más bajo, llamado área catódica.
Corrosión por oxígeno
Este tipo de corrosión ocurre generalmente en superficies expuestas aloxígeno diatómico disuelto en agua o al aire, se ve favorecido por altas temperaturas y presión elevada ( ejemplo: calderas de vapor). La corrosión en las máquinas térmicas (calderas de vapor) representa una constante pérdida de rendimiento y vida útil de la instalación.
Corrosión microbiológica
Es uno de los tipos de corrosión electroquímica. Algunos microorganismos son capaces de causar corrosión en las superficies metálicas sumergidas. Se han identificado algunas especies hidrógeno dependientes que usan el hidrógeno disuelto del agua en sus procesos metabólicos provocando una diferencia de potencial del medio circundante. Su acción está asociada al pitting (picado) del oxígeno o la presencia de ácido sulfhídrico en el medio. En este caso se clasifican lasferrobacterias.
Corrosión por presiones parciales de oxígeno
El oxígeno presente en una tubería por ejemplo, está expuesto a diferentes presiones parciales del mismo. Es decir una superficie es más aireada que otra próxima a ella y se forma una pila. El área sujeta a menor aireación (menor presión parcial) actúa como ánodo y la que tiene mayor presencia de oxígeno (mayor presión) actúa como un cátodo y se establece la migración de electrones, formándose óxido en una y reduciéndose en la otra parte de la pila. Este tipo de corrosión es común en superficies muy irregulares donde se producen obturaciones de oxígeno.
Corrosión galvánica
Es la más común de todas y se establece cuando dos metales distintos entre sí actúan como ánodo uno de ellos y el otro como cátodo. Aquel que tenga elpotencial de reducción más negativo procederá como una oxidación y viceversa aquel metal o especie química que exhiba un potencial de reducción más positivo procederá como una reducción. Este par de metales constituye la llamada pila galvánica. En donde la especie que se oxida (ánodo) cede sus electrones y la especie que se reduce (cátodo) acepta los electrones.
homogéneos y heterogéneos, metálicos y no metálicos, inorgánicos y orgánicos, etc.
- Según sus propiedades, los materiales se pueden clasificar en rígidos y flexibles,
tenaces y frágiles, conductores y aislantes, reciclables y no reciclables, etc.
En este caso, a continuación, voy a hablar de los materiales metálicos.
1.- Clasificación de los materiales metálicos
Dentro de los materiales metálicos, se divide en dos grupos:
-Materiales ferrosos en los que se encuentran; hierro fundido, acero al carbon, acero de aleación y acero inoxidable.
- Materiales no ferrosos en los que están; aluminio, cobre, laton, bronce, zinc (o cinc, ambos son válidos), magnesio, titanio, estaño, y plomo
En primer lugar vamos a hablar de los materiales ferrosos, en el cual, el acero, metal ferroso por excelencia, presenta características particulares que lo hacen muy utilizado en diversas áreas. Se trata de un material maleable, resistente, lustroso así como conductor de calor y electricidad.
Los minerales de hierro (elemento principal del acero) constituyen el cuarto elemento más común en la corteza terrestre. La abundancia de las materias primas para la fabricación de acero como los bajos costos de producción han llevado a su extendido uso a todo nivel.
El acero tiene un proceso de fabricación en el cual se producen el acero al carbón, acero de aleación y acero inoxidable, en el que, el acero es principalmente una aleación de hierro y carbón. Contiene muy bajos porcentajes de
manganeso, sílice, fósforo, azufre y oxígeno.
Se fabrica mediante la fundición de minerales de hierro en un horno para producir lingotes de hierro que son añadidos con hierro de rechazo (o proveniente de reciclaje) antes de someterse a purificación.
Existen dos técnicas principales para la fabricación de acero:
- Hornos a base de oxígeno: para producción de acero laminado.
- Hornos de arco eléctrico: utilizan un 100% de acero de descarte.
La propiedades mecánicas del acero, varían según sus componentes y el tratamiento al calor al que fue sometido.
Anteriormente, los hornos de oxígeno eran hornos abiertos pero hoy en día se realiza un proceso de oxigenación soplando oxígeno casi puro sobre la superficie de hierro fundido.
Existen distintos tipos de aceros:
- Acero blando: contiene menos de 0,15% de carbono
- Acero intermedio: contiene entre 0,15% y 0,3% de carbono
- Acero duro: contiene más de 0,3% de carbono
- Acero inoxidable: es un aleación de acero que contiene más de 8% de elementos de
aleación como cromo, níquel y sílice.
- Acero galvanizado: acero recubierto de zinc para potegerlo de corrosión atmosférica.
- Acero para latas utilizado para almacenar alimentos: cuenta con una pequeña capa de estaño que lo hace resistente a los ataques de ácidos orgánicos y a la oxidación.
Reciclaje de acero
 |
| Clasifiación materiales metálicos |
-Materiales ferrosos en los que se encuentran; hierro fundido, acero al carbon, acero de aleación y acero inoxidable.
- Materiales no ferrosos en los que están; aluminio, cobre, laton, bronce, zinc (o cinc, ambos son válidos), magnesio, titanio, estaño, y plomo
En primer lugar vamos a hablar de los materiales ferrosos, en el cual, el acero, metal ferroso por excelencia, presenta características particulares que lo hacen muy utilizado en diversas áreas. Se trata de un material maleable, resistente, lustroso así como conductor de calor y electricidad.
Los minerales de hierro (elemento principal del acero) constituyen el cuarto elemento más común en la corteza terrestre. La abundancia de las materias primas para la fabricación de acero como los bajos costos de producción han llevado a su extendido uso a todo nivel.
El acero tiene un proceso de fabricación en el cual se producen el acero al carbón, acero de aleación y acero inoxidable, en el que, el acero es principalmente una aleación de hierro y carbón. Contiene muy bajos porcentajes de
manganeso, sílice, fósforo, azufre y oxígeno.
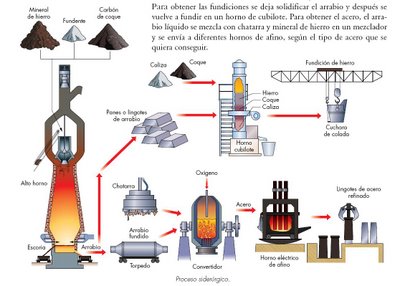 |
| Proceso de fabricación del acero |
Existen dos técnicas principales para la fabricación de acero:
- Hornos a base de oxígeno: para producción de acero laminado.
 |
| Funcionamiento de horno a base de oxígeno |
 |
| Funcionamiento horno de arco eléctrico |
La propiedades mecánicas del acero, varían según sus componentes y el tratamiento al calor al que fue sometido.
Anteriormente, los hornos de oxígeno eran hornos abiertos pero hoy en día se realiza un proceso de oxigenación soplando oxígeno casi puro sobre la superficie de hierro fundido.
Existen distintos tipos de aceros:
- Acero blando: contiene menos de 0,15% de carbono
- Acero intermedio: contiene entre 0,15% y 0,3% de carbono
- Acero duro: contiene más de 0,3% de carbono
- Acero inoxidable: es un aleación de acero que contiene más de 8% de elementos de
aleación como cromo, níquel y sílice.
- Acero galvanizado: acero recubierto de zinc para potegerlo de corrosión atmosférica.
- Acero para latas utilizado para almacenar alimentos: cuenta con una pequeña capa de estaño que lo hace resistente a los ataques de ácidos orgánicos y a la oxidación.
Reciclaje de acero
El reciclaje de acero implica principalmente remover los contaminantes para luego fundirlo y volver a forjarlo.
En el caso particular de las latas de alimentos, es necesario remover el estaño. Primero se debe triturar y remover contaminantes para posteriormente realizar la remoción electrolítica de la placa de estaño.
Aquel acero que no contiene estaño tan solo requiere de un buen lavado para remover sustancias químicas para su posterior procesamiento.
El acero es facilmente identificable en los residuos urbanos a través de la separación magnética. Si se logra obtenerlo sin ningún tipo de contaminantes, se trata de un material 100% reciclable y puede reciclarse infinidad de veces. Sin embargo suele encontrarse con algunos elementos que complican su reciclaje como las varillas con hormigón, cercas o tuberías enterradas.
Los autos viejos, el material de construcción y los electrodomésticos (cocinas, hornos, lavadoras, heladeras) son una constante fuente de chatarra de hierro y acero.
Previo al reciclaje, es fundamental adquirir prácticas de disminución de la generación de residuos y para el caso de las latas de acero, algunas de las alternativas podrían ser el reducir el espesor de estas latas, sin perder su resistencia y manteniendo sus cualidades como material reciclable.
Esquema de reciclaje de acero utilizado para hojalata
A continuación voy a mostrar el uso específico de los metales ferrosos en el automóvil.
En varias aplicaciones a los vehículos el acero inoxidable también juega un papel muy
significatiivo, más particularmente en el sistema de escape, los paneles exteriores, el motor, las baguetas y otros. Las partes del sistema de escape están siempre sujetas a la corrosión por los gases y las temperaturas elevadas, de tal son creadas usando materiales concebidos para resistir en condiciones extremas y esto es seguramente la mejor elección, usar acero inoxidable.
Además, el acero inoxidable es usado en otras partes de los vehículos como los casquetes, los cuerpos de las bombas, los clamps de las mangueras, las escobillas de los limpiaparabrisas, resortes de asientos y muchas otras.
El sistema de suspensión también está creado usando este noble metal que puede ayudar a reducir el peso de un vehículo en un 25% haciéndolo de tal modo más liviano.
En el caso particular de las latas de alimentos, es necesario remover el estaño. Primero se debe triturar y remover contaminantes para posteriormente realizar la remoción electrolítica de la placa de estaño.
Aquel acero que no contiene estaño tan solo requiere de un buen lavado para remover sustancias químicas para su posterior procesamiento.
El acero es facilmente identificable en los residuos urbanos a través de la separación magnética. Si se logra obtenerlo sin ningún tipo de contaminantes, se trata de un material 100% reciclable y puede reciclarse infinidad de veces. Sin embargo suele encontrarse con algunos elementos que complican su reciclaje como las varillas con hormigón, cercas o tuberías enterradas.
Los autos viejos, el material de construcción y los electrodomésticos (cocinas, hornos, lavadoras, heladeras) son una constante fuente de chatarra de hierro y acero.
Previo al reciclaje, es fundamental adquirir prácticas de disminución de la generación de residuos y para el caso de las latas de acero, algunas de las alternativas podrían ser el reducir el espesor de estas latas, sin perder su resistencia y manteniendo sus cualidades como material reciclable.
Esquema de reciclaje de acero utilizado para hojalata
Residuos de metales ferrosos
|
Trituradora
|
Clasificación para separación de livianos
|
Tambor para separación de grandes
|
Separación de estaño
|
Lavado/embalaje
|
Acero libre de estaño
|
A continuación voy a mostrar el uso específico de los metales ferrosos en el automóvil.
En varias aplicaciones a los vehículos el acero inoxidable también juega un papel muy
 |
| Tubo de escape de acero inoxidable en un coche |
 |
| Tubo de escape acero inoxidable |
Además, el acero inoxidable es usado en otras partes de los vehículos como los casquetes, los cuerpos de las bombas, los clamps de las mangueras, las escobillas de los limpiaparabrisas, resortes de asientos y muchas otras.
El sistema de suspensión también está creado usando este noble metal que puede ayudar a reducir el peso de un vehículo en un 25% haciéndolo de tal modo más liviano.
 |
| Engranajes de acero inoxidable |
El acero de aleación es utilizado para las llantas de los vehículos, el acero de aleación no es muy utilizado en los vehículos.
 |
| Llantas de acero de aleación |
Después de haber comentado los materiales ferrosos, voy a presentar los materiales no ferrosos, que son cada día más prescindibles.
Clasificación
Se pueden clasificar en tres grupos
- Metales no ferrosos pesados: Son aquellos cuya densidad es igual o mayor a 5 gr/cm3
. Se encuentran en este grupo el cobre, el estaño, el plomo, el cinc, el níquel, el cromo y el cobalto.
. Se encuentran en este grupo el cobre, el estaño, el plomo, el cinc, el níquel, el cromo y el cobalto.
- Metales no ferrosos ligeros: Tienen una densidad comprendida entre 2 y 5 gr/cm3. Los más utilizados son el aluminio y el titanio.
- Metales no ferrosos ultraligeros: Su densidad es menor a 5 gr/cm3. Se encuentran en este grupo el berilio y el magnesio, aunque el primero de ellos raramente se encuentra en estado puro, sino como elemento de aleación.
Todos estos metales no ferrosos, es estado puro, son blandos y poseen una resistencia mecánica bastante reducida. Para mejorar sus propiedades, los metales puros suelen alearse con otros.
El cobre se encuentra generalmente en la naturaleza formando minerales, siendo los más
 |
| Mineral de cobre |
importantes los minerales sulfurados (calcopirita y calcosina) y los óxidos (malaquita y
cuprita). El proceso de obtención del cobre puro a partir de estos minerales es por vía seca.
Las propiedades del cobre son:
- Conductividad térmica y eléctrica muy alta
- Resistencia a la corrosión
- Dúctil y maleable
- Se deja soldar con facilidad
y es utilizado..
- Por su buena conductividad eléctrica se usa como conductor eléctrico en cables de baja
tensión.
- Por su buena conductividad térmica se usa en intercambiadores de calor, refrigeradores, calderas,…
- Por ser dúctil y maleable es susceptible de dejarse conformar en delgadísimas láminas
empleadas en objetos de artesanía y en la industria.
La adicción (aleación) de elementos al cobre disminuye su conductividad eléctrica y térmica, pero
mejora sus propiedades mecánicas y su resistencia a la corrosión. Las aleaciones de cobre más importantes son: Bronce y Latón.
El cobre es utilizado en los vehículos como conductor de electricidad, puesto que es un buen conductor y además tiene un bajo coste.
El bronce, es una aleación de cobre y estaño, normalmente con menos de un 30 % de estaño. Si sólo lleva estos dos elementos se denomina bronce ordinario y si además se le
añaden otros elementos que le confieren propiedades determinadas ( como cinc, fósforo, plomo, silicio) se denominan bronces especiales.
| Piezas de bronce |
Las propiedades del bronce;
- Es duro, pero dúctil y maleable.
- Más resistente a la corrosión que el cobre
- Conserva la conductividad térmica y eléctrica aunque en menor medida.
y su uso es...
líquidos y gases y otros accesorios para calefacción.
- Los más duros (con más Sn) para campanas y timbres.
- Los más blandos (con menos Sn) para fabricar chapas, alambres y medallas o
monedas estampadas.
El laton, es una aleación de cobre y cinc (30 a 55 %). Si además hay otros elementos se denominan latones especiales (manganeso, plomo,…).
 |
| Tubos de laton |
Propiedades:
- Es dúctil y maleable.
- Buen conductor de la electricidad y el calor.
- Resiste bien a la corrosión, especialmente ante agua y vapor caliente.
Aplicaciones:
Se usa para la fabricación de numerosas piezas fundidas, forjadas o mecanizadas, entre
ellas: tornillería, remaches, elementos de maquinas, griferías, elementos de
decoración,…
 |
| Antigua bocina de un vehículo, fabricada en laton |
El estaño puro tiene un color blanco brillante.
El estaño se obtiene a partir de un mineral denominado casiterita (78% de Sn). La casiterita
 |
| Mineral de estaño |
se reduce en presencia de Carbono y elevada temperatura, de forma que se elimina así el
oxígeno transformándose en estaño bruto.
Por refundiciones sucesivas o por procesos electrolíticos se obtiene el estaño puro.
PROPIEDADES
- Resistencia a la corrosión (es inoxidable)
- Maleable y poco dúctil
- Cuando se dobla se oye un crujido llamado “grito del estaño”.
APLICACIONES
- Por su resistencia la corrosión se emplea en la fabricación de hojalata, que se obtiene
al recubrir láminas de hierro con una capa exterior de estaño por inmersión en baño de
estaño fundido. Se usa mucho en envases alimenticios.
- Por su maleabilidad, en la fabricación de papel de estaño, para cubrir alimentos.
- Es muy importante su aleación con cobre para obtener bronce.
- También para obtener soldadura blanca al alearlo con plomo.
 |
| Estaño-plomo para la reparación de carrocería |
El estaño se utiliza en la automoción para la reparación de la carrocería, específicamente se usa el estaño-plomo.
El cinc es de color blanco azulado y se obtiene principalmente a partir del mineral blenda (que
tiene 67% de cinc y azufre).
 |
| Zinc mineral |
El proceso es el siguiente:
1. La blenda se somete a calcinación en presencia de aire puro para eliminar el azufre.
Durante este proceso el zinc se combina con oxigeno para formar óxido de cinc. Por su
parte el acero se elimina en forma de SO2 gaseoso que se suele usar para fabricar ácido
sulfúrico.
2. El óxido de cinc (ZnO) se reduce a continuación para obtener cinc bruto metálico
siguiendo 2 pasos:
a. Por vía seca o reducción: El óxido de cinc se lleva a una temperatura de 1000ºC en
 |
| Zinc metálico puro |
un horno. El cinc liberado se evapora y se escapa del horno para condensarse en
estado líquido por enfriamiento en un condensador. Este cinc que se obtiene no es
puro, suele llevar impurezas.
b. Se somete a electrolisis para purificar el cinc: Para ello el cinc fundido se introduce
en unas células electrolíticas, donde al aplicar una diferencia de potencial el cinc se
deposita en el electrodo negativo.
PROPIEDADES
- Resistencia a la corrosión. Se autoprotege contra la corrosión mediante una capa
superficial de óxidos.
- Posee un coeficiente de dilatación térmica muy alto.
- A temperatura ambiente es frágil y quebradizo, pero entre 100 y 150 ºC es muy
maleable.
APLICACIONES
- Para cubiertas de tejados, canales y otros elementos sometidos a la acción de agentes
atmosféricos.
- Como elemento de aleación en latones (cobre y cinc)
- Como protector de metales corrosibles como el hierro, mediante el galvanizado. Dicho
proceso consiste en introducir la pieza de hierro o acero en un baño de cinc fundido.
Con ello se protege de la oxidación.
 |
| Alas echos de aleación de zinc |
El zinc se utiliza para la realizacion de algunas piezas de vehículos, y también es utilizado en los coches modernos, el cual es fabricado principalmente con chapa de acero recuebierta de zinc, lo que mejora la corrosión del acero.
El plomo es de color gris azulado y se obtiene a partir de la galena (que es un mineral
formado por sulfuro de plomo, PbS, con un 85 % de Pb). El proceso es el siguiente:
 |
| Mineral de plomo |
1. Se tuesta el mineral, calentándolo mientras es atravesado por una corriente de aire, con
lo que se elimina el azufre. Se obtiene óxido de plomo. 5
2. Reducción por fusión en un horno de cuba para separar el oxígeno del plomo y
transformar éste en plomo bruto.
3. Se eliminan impurezas por medio de una fusión denominada de refinado y se obtiene el
plomo puro.
PROPIEDADES
• Anticorrosivo: Resiste bien los agentes atmosféricos (en el aire se autoprotege
formando de óxido) y químicos, aunque atacado por la mayoría de ácidos orgánicos
débiles.
• Muy blando y maleable.
• Buen conductor del calor y la electricidad.
• Pesado.
• Para fabricación de elementos que han de trabajar en ambientes corrosivos:
revestimiento de aparatos y depósitos de la industria química y eléctrica, tuberías para
gas o agua, aunque en esta última aplicación está siendo sustituido por el PVC.
• Como elemento de protección contra los rayos X en medicina.
• Para fabricación de pinturas antioxidantes.
• Para mejorar el rendimientote la gasolina y reducir su contaminación en la combustión.
ALEACIONES DE PLOMO
El plomo y el estaño forman parte de numerosas aleaciones en las que a menudo interviene
también el antimonio. Las principales son:
• Soldadura blanda: aleación de estaño (25 al 90 %) y plomo.
• Metal antifricción: aleaciones empleadas en los cojinetes de distintos mecanismos.
• Metal de imprenta: aleación de Sn + Pb + Zn para los tipos y máquinas de imprenta.
• Plomo duro: aleación con un 10 % de antimonio. Se emplea en juguetes, cubiertos
económicos,…
El plomo es utilizado en los vehículos para la electricidad, las terminales de la batería estan echas de plomo.
 |
| Terminal de plomo |
El aluminio es de color blanco plateado y se obtiene en la actualidad, el método Bayer es el único empleado por ser el más barato. Se parte del mineral bauxita (óxido de aluminio que
contiene 55-60 % de Al, además de ácido silícico y óxido de hierro) y se sigue el siguiente proceso:
| Mineral de aluminio |
1. La bauxita, una vez molida, es atacada con una disolución de sosa cáustica (35% en
volumen) a presiones y temperaturas elevadas. De aquí se obtiene la alúmina por
precipitación.
2. Para obtener el aluminio a través de la alúmina se disuelve ésta en criolita fundida, que
protege el baño de la oxidación, a una temperatura de unos 1000ºC y se la somete a un
proceso de electrólisis que la descompone en aluminio y oxígeno. En dicho proceso, el
aluminio se va depositando en la parte inferior de la cuba recubierta de grafito al que va
conectado el borne positivo de la cuba. Al mismo tiempo, se desprende oxígeno en
forma de CO y CO2. Se extrae el aluminio por esa parte inferior de la cuba.
PROPIEDADES
- Material ligero.
- Inoxidable al aire libre al cubrirse por una débil capa de óxido que lo protege.
- No le atacan las sustancias orgánicas.
- Maleable y dúctil. Fácil de mecanizar.
- Buen conductor de la electricidad.
APLICACIONES
- Por su buena conductividad eléctrica y poco peso se usa en líneas eléctricas de alta
tensión.
- Por su resistencia a la corrosión se emplea en útiles de cocina, carpintería metálica y
fabricación de pinturas resistentes a estados atmosféricos.
- Por su poco peso en: construcciones aeronáuticas, ferroviarias, automovilísticas y
estructuras metálicas.
- Por elevada maleabilidad para papel de aluminio, como envoltura de alimentos.
- En aleaciones ligeras.
ALEACIONES LIGERAS DE ALUMINIO
Se dividen en dos categorías:
- Aleaciones para moldeo: las más comunes son con cobre, con magnesio o con silicio.
Reducen el coeficiente de contracción, evitando que se produzcan griets o roturas.
 |
| El pistón es una de las piezas echas de aluminio utilizadas en los automoviles |
- Aleaciones para forja: Elevan la resistencia mecánica del aluminio.
Este tipo de aleaciones tiene diversas aplicaciones:
- Construcciones marinas y aeronáuticas.
- Elementos de elevadas características mecánicas: émbolos, culatas, cojinetes,…
- Elementos ligeros: CD-ROM, botes de refresco, cuadros de bicicletas,…
El titanio es de color blanco plateado y se obtiene del rutilo (trióxido de titanio TiO3), el cual
se trata con cloro en atmósfera inerte obteniéndose el tetracloruro de titanio (TiCl4). Tratando éste en atmósfera inerte con magnesio a elevadas temperaturas se obtiene el titanio puro.
 |
| Mineral de titanio |
PROPIEDADES
- Buena resistencia a la corrosión (más que el acero inoxidable)
- Buena resistencia mecánica.
- Ligero.
APLICACIONES
En aeronáutica, navegación, autocares, material bélico (proyectiles, misiles),
transbordadores y naves espaciales. En forma de óxido y pulverizado como elemento
antioxidante en la fabricación de pinturas.
El titanio es utilizado en los vehiculos para hacerles más ligeros y más resistentes.
 |
| Sistema de escape de titanio |
El magnesio tiene un color y brillo semejante a la plata, y se obtiene principalmente a partir de sus minerales: magnesita, dolomita y carnalita.
PROPIEDADES
- Muy ligero.
- Más resistente que el aluminio, pero conduce peor la electricidad y el calor.
- Muy maleable y poco dúctil.
- No se oxida en presencia de aire seco, pero cuando hay humedad se corroe con
facilidad.
- Se mecaniza bien.
APLICACIONES
En estado puro tiene pocas aplicaciones, sólo en pirotecnia y en fotografía, ya que en su
combustión desprende gran luminosidad.
ALEACIONES DEL MAGNESIO
Sus principales aleaciones son con aluminio, cinc y manganeso. Tienen bajo peso
específico (ligeros) y buena maquinabilidad. Se emplean en la fabricación de maquinaria,
motores, trenes y automóviles de carreras.
General Motors tiene avanzadas las pruebas en las que se trabaja con el magnesio para crear  |
| Mineral de magnesio |
PROPIEDADES
- Muy ligero.
- Más resistente que el aluminio, pero conduce peor la electricidad y el calor.
- Muy maleable y poco dúctil.
- No se oxida en presencia de aire seco, pero cuando hay humedad se corroe con
facilidad.
- Se mecaniza bien.
APLICACIONES
En estado puro tiene pocas aplicaciones, sólo en pirotecnia y en fotografía, ya que en su
combustión desprende gran luminosidad.
ALEACIONES DEL MAGNESIO
Sus principales aleaciones son con aluminio, cinc y manganeso. Tienen bajo peso
específico (ligeros) y buena maquinabilidad. Se emplean en la fabricación de maquinaria,
motores, trenes y automóviles de carreras.
 |
| Pieza de la carrocería de un automovil echa de magnesio |
- Magnesio: Las estructuras de magnesio podrían ahorrar un 15% del peso del coche.
- Consumo: El menor peso podría conllevar una rebaja de un 9 a un 12% en el consumo de combustible.
- Corrosión: Un nuevo proceso de producción evita los problemas de corrosión del magnesio.
2020: En 2020 se espera que el magnesio ayude a reducir en más de 100 kg el peso de los coches.
2.- Enlace metálico
Mediante la estructura del enlace metálico podemos explicarnos las propiedades más
características de los metales, tales como su facilidad para conducir la electricidad y el calor (conductividad), la capacidad para extenderse en hilos muy finos (ductilidad) , la capacidad para obtener láminas finas (maleabilidad), densidades elevadas, puntos de fusión altos... etc.
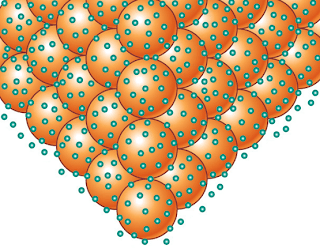 | ||||
| Nube electronica en tres dimensiones |
El modelo más sencillo de enlace metálico se basa en una de las propiedades características de los metales: su baja electronegatividad (ceden electrones con facilidad). Así pues, el enlace metálico podemos describirlo como una disposición muy ordenada y compacta de iones positivos del metal (red metálica) entre los cuales se distribuyen los electrones perdidos por cada átomo a modo de “nube electrónica”. Es importante observar que los electrones pueden circular libremente entre los cationes, no están ligados (sujetos) a lo núcleos y son compartidos por todos ellos (se dice que los electrones están deslocalizados). Esta nube electrónica hace de “colchón” entre las cargas positivas impidiendo que se repelan, a la vez que mantienen unidos los átomos del metal.
3.- Características físicas/químicas de los materiales metálicos
Los metales tienen ciertas propiedades físicas características: a excepción del mercurio son sólidos a condiciones ambientales normales, suelen ser opacos y brillantes, tener alta densidad, ser dúctiles y maleables, tener un punto de fusión alto, ser duros, y ser buenos conductores del calor y electricidad. Estas propiedades se deben al hecho de que los electrones exteriores están ligados sólo ligeramente a los átomos, formando una especie de mar (también conocido como mar de Drude), que se conoce como Enlace metálico. Los materiales metálicos, al estar enterrados durante mucho tiempo, sufren ataques diferentes a otros materiales extraídos de excavaciones arqueológicas.
Es característico de los metales tener valencias positivas en la mayoría de sus compuestos. Esto significa que tienden a ceder electrones a los átomos con los que se enlazan. También tienden a formar óxidos básicos. Por el contrario, elementos no metálicos como el nitrógeno, azufre y cloro tienen valencias negativas en la mayoría de sus compuestos, y tienden a adquirir electrones y a formar óxidos ácidos
Los metales tienen energía de ionización baja: reaccionan con facilidad perdiendo electrones para formar iones positivos o cationes. De este modo, los metales forman sales como cloruros, sulfuros y carbonatos, actuando como agentes reductores (donantes de electrones).
Los metales tienen energía de ionización baja: reaccionan con facilidad perdiendo electrones para formar iones positivos o cationes. De este modo, los metales forman sales como cloruros, sulfuros y carbonatos, actuando como agentes reductores (donantes de electrones).
4.- Estructura interna de los materiales metálicos
Estudios de difracción de rayos X han permitido determinar la estructura de muchos elementos metálicos, revelando la existencia de empaquetamientos compactos en muchos de ellos. Ello indica que presenta una débil tendencia a formar en esas estructuras enlaces covalentes dirigidos. Una consecuencia del compactación es la alta densidad de dichos metales, ya que existe una gran cantidad de masa en un volumen mínimo.
Estudios de difracción de rayos X han permitido determinar la estructura de muchos elementos metálicos, revelando la existencia de empaquetamientos compactos en muchos de ellos. Ello indica que presenta una débil tendencia a formar en esas estructuras enlaces covalentes dirigidos. Una consecuencia del compactación es la alta densidad de dichos metales, ya que existe una gran cantidad de masa en un volumen mínimo.
Dependiendo del tipo de fuerzas que unen el átomo y la molécula, se obitenen diferentes características.
Hay diferentes tipos de estructuras, las cuales vamos a comentar a continuación:
Hay diferentes tipos de estructuras, las cuales vamos a comentar a continuación:
Estructura cúbica centradaFormada por un átomo del metal en cada uno de los vértices de un cubo y un átomo en el centro. Los metales que cristalizan en esta estructura son: hierro alfa, titanio, tungsteno, molibdeno, niobio, vanadio, cromo, circonio, talio, sodio y potasio.
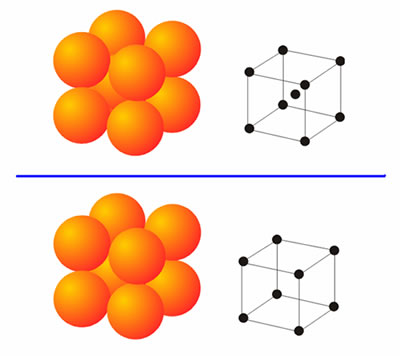 |
| Arriba, estructura cúbica centrada en el cuerpo. Abajo, estructura cúbica-primitiva. |
Estructura cúbica centrada en el cuerpo
Cada átomo de la estructura, está rodeado por ocho átomos adyacentes y los átomos de los vértices están en contacto según las diagonales del cubo |
| Diferencia entre las estructuras cúbicas |
Estructura cúbica centrada en las caras Está constituida por un átomo en cada vértice y un átomo en cada cara del cubo. Los metales que cristalizan en esta estructura son: hierro gama, cobre, plata, platino, oro, plomo y níquel.
 |
Estructura hexagonal compacta
Esta estructura está determinada por un átomo en cada uno de los vértices de un prisma hexagonal, un átomo en las bases del prisma y tres átomos dentro de la celda unitaria.
Cada átomo está rodeado por doce átomos y estos están en contacto según los lados de los hexágonos bases del prisma hexagonal.
Los metales que cristalizan en esta forma de estructura son: titanio, magnesio, cinc, berilio, cobalto, circonio y cadmio.
Algunos metales sufren cambio de estructura a diferentes temperaturas como el hierro que se presenta como cúbico centrado a temperatura normal pero cambia a centrado en las caras a 912°C y vuelve a ser cúbico centrado a 1400°C; cuando un metal cambia su estructura de esta manera se dice que es alotrópico
 |
| Comparación |
5.- Pureza y aleaciones
- PUREZA: La pureza es la cualidad de puro (aquel o aquello que está libre y exento de toda mezcla de otra cosa, que no incluye ninguna condición, excepción o restricción ni plazo o que
está exento de imperfecciones morales.
La pureza tiene una unidad de medida, determinada como; ley, la cual es utilizada para los metales preciosos.
Cualquier metal por puro que sea, nunca va a ser totalmente puro, puesto que siempre va a tener un pequeño porcentaje de impurezas debido a la propiedades fisica y quimicas de la obtención de este.
Los metales más puros que hay son el oro, la plata y el platino. Nos encontramos con el hecho de que el oro se puede clasificar en tres tipos claramente diferenciados en base a su pureza. Así, está el oro medio, que tiene una pureza del 50%; el de primera ley, que cuenta con un 75%; y finalmente el puro, que posee un 99% de pureza.
 |
| Aquí podemos ver oro, el metal más puro |
La pureza tiene una unidad de medida, determinada como; ley, la cual es utilizada para los metales preciosos.
Cualquier metal por puro que sea, nunca va a ser totalmente puro, puesto que siempre va a tener un pequeño porcentaje de impurezas debido a la propiedades fisica y quimicas de la obtención de este.
Los metales más puros que hay son el oro, la plata y el platino. Nos encontramos con el hecho de que el oro se puede clasificar en tres tipos claramente diferenciados en base a su pureza. Así, está el oro medio, que tiene una pureza del 50%; el de primera ley, que cuenta con un 75%; y finalmente el puro, que posee un 99% de pureza.
- Aleación: la mayoría de los metales se producen como aleaciones debido a que los
yacimientos contienen típicamente múltiples metales. El metal deseado debe ser extraído de otros metales y materiales de desecho, después de lo cual se refina, dejando un metal puro. Los fabricantes crean aleaciones de dos o más metales puros combinados mediante el uso de calor. Tanto las aleaciones como los metales puros tienen sus ventajas y desventajas, según su aplicación.
Las aleaciones, principalmente se producen para darle al metal, diferentes tipos de características, es decir, mediante la aleación lo manipulamos para formar un metal mejor para el uso que le vamos a dar.
Los diferentes elementos que se utilizan en dichas aleaciones son los siguientes:
-Aluminio
El aluminio es usado principalmente como desoxidante en la elaboración de acero. También reduce el crecimiento del grano al formar óxidos.
- Azufre
El Azufre se considera como un elemento perjudicial en las aleaciones de acero, una impureza. Sin embargo, en ocasiones se agrega hasta 0.25% de azufre para mejorar la maquinabilidad. Los aceros altos en azufre son difíciles de soldar pueden causar porosidad en las soldaduras.
- Carbono
El Carbono es el elemento de aleación más efectivo, eficiente y de bajo costo.
En aceros enfriados lentamente, el carbón forma carburo de hierro y cementita, la cual con la ferrita forma a su vez la perlita. Cuando el acero se enfría más rápidamente, el acero al carbón muestra endurecimiento superficial.
El carbón es el elemento responsable de dar la dureza y alta resistencia del acero.
- Boro
El Boro logra aumentar la capacidad de endurecimiento cuando el acero está totalmente desoxidado. Una pequeña cantidad de Boro, (0.001%) tiene un efecto marcado en el endurecimiento del acero, ya que también se combina con el carbono para formar los carburos que dan al acero características de revestimiento duro.
- Cobalto
El Cobalto es un elemento poco habitual en los aceros, ya que disminuye la capacidad de endurecimiento.
- Cobre
EL cobre se suele emplear para mejorar la resistencia a la corrosión de ciertos aceros de 0,15 a 0,30% de carbono, que se usan para grandes construcciones metálicas. Se suelen emplear contenidos de cobre variables de 0,4 a 0,5 %.
- Cromo
El Cromo es un formador de ferrita, aumentando la profundidad del endurecimiento. Así mismo, aumenta la resistencia a altas temperaturas y evita la corrosión.
El Cromo es un elemento principal de aleación en aceros inoxidables, y debido a su capacidad de formar carburos se utiliza en revestimientos o recubrimientos duros de gran resistencia al desgaste, como émbolos, ejes, etc.
 |
Proceso de aleación |
Las aleaciones, principalmente se producen para darle al metal, diferentes tipos de características, es decir, mediante la aleación lo manipulamos para formar un metal mejor para el uso que le vamos a dar.
Los diferentes elementos que se utilizan en dichas aleaciones son los siguientes:
-Aluminio
El aluminio es usado principalmente como desoxidante en la elaboración de acero. También reduce el crecimiento del grano al formar óxidos.
- Azufre
El Azufre se considera como un elemento perjudicial en las aleaciones de acero, una impureza. Sin embargo, en ocasiones se agrega hasta 0.25% de azufre para mejorar la maquinabilidad. Los aceros altos en azufre son difíciles de soldar pueden causar porosidad en las soldaduras.
- Carbono
El Carbono es el elemento de aleación más efectivo, eficiente y de bajo costo.
En aceros enfriados lentamente, el carbón forma carburo de hierro y cementita, la cual con la ferrita forma a su vez la perlita. Cuando el acero se enfría más rápidamente, el acero al carbón muestra endurecimiento superficial.
El carbón es el elemento responsable de dar la dureza y alta resistencia del acero.
- Boro
El Boro logra aumentar la capacidad de endurecimiento cuando el acero está totalmente desoxidado. Una pequeña cantidad de Boro, (0.001%) tiene un efecto marcado en el endurecimiento del acero, ya que también se combina con el carbono para formar los carburos que dan al acero características de revestimiento duro.
- Cobalto
El Cobalto es un elemento poco habitual en los aceros, ya que disminuye la capacidad de endurecimiento.
- Cobre
EL cobre se suele emplear para mejorar la resistencia a la corrosión de ciertos aceros de 0,15 a 0,30% de carbono, que se usan para grandes construcciones metálicas. Se suelen emplear contenidos de cobre variables de 0,4 a 0,5 %.
- Cromo
El Cromo es un formador de ferrita, aumentando la profundidad del endurecimiento. Así mismo, aumenta la resistencia a altas temperaturas y evita la corrosión.
El Cromo es un elemento principal de aleación en aceros inoxidables, y debido a su capacidad de formar carburos se utiliza en revestimientos o recubrimientos duros de gran resistencia al desgaste, como émbolos, ejes, etc.
6.- Historia de la humanidad relacionada con los materiales metalicos
El bronce le permitió a los imperios de la antigüedad producir armas para los ejércitos de conquista. La agricultura y la artesanía tuvieron herramientas fuertes y la producción creció. Desde entonces los metales sirvieron para muchos fines. El oro y la plata adornaron a los grandes personajes y los acompañaron en sus sepulcros. El culto religioso se sirvió de ellos para elaborar ornamentos y símbolos.
El 1000 antes de Cristo casi todos los pueblos del Viejo Mundo tenían metales; desde el Mediterráneo, pasando por Persia e India, se hicieron en bronce y oro armas, instrumentos y adornos variados. Desde China la metalurgia se extendió a Japón, en donde los aceros armaron a los samuráis, y también al sureste asiático cuyos templos se coronaron con cúpulas doradas.
Para la época en que cayó el Imperio Romano los implementos de metal eran parte de la vida diaria. Ya no se podía entender el comercio sin la moneda ni las actividades cotidianas sin herramientas metálicas. Las religiones del mundo antiguo en Asia, África y Europa, recurrieron al oro y la plata para forjar los objetos sagrados. En el convulsionado mundo medieval chocaron en la guerra los metales de Occidente y los de Oriente.
Desde 1300 los estados del occidente de África, al sur del Sahara, usaron el bronce para decorar las ciudadelas reales. Para surtir de materias primas a los herreros y distribuir sus productos se organizaron caravanas que cruzaban el desierto. Los orfebres africanos se convirtieron en maestros de la fundición; los adornos y delicadas miniaturas comunican una profunda simbología.
Los antiguos suramericanos empezaron a trabajar el cobre y el oro alrededor de 1500 antes de Cristo. Unos mil años más tarde varias culturas andinas adornaban a sus líderes con suntuosos atuendos. El oro y la plata se reservaron para los gobernantes y la religión; los objetos rituales y simbólicos comunicaban una visión del mundo que compartía toda la sociedad.
La metalurgia en la Colombia prehispánica fue, ante todo, orfebrería. En dos mil años surgieron muchos estilos diferentes y se fabricaron miles de piezas para el ritual y la ofrenda. Los indígenas manejaron con maestría el oro, el cobre, la tumbaga y el platino. La conquista europea, en 1500, truncó este desarrollo y causó la desaparición de la producción orfebre.
En los últimos 300 años la producción de metales ha tenido un gran avance. La gran industria usa millones de toneladas de metales cada año; también las sociedades no industriales consumen cada vez más metales para los más variados propósitos. La historia de la humanidad en los últimos nueve mil años es la historia de los metales: con ellos hemos construido el mundo en que vivimos.
7.- Extracción, producción y reciclado de materiales metálicos
EXTRACCION Y PRODUCCION
La metalurgia tiene por objeto la extracción de los minerales por una serie de medios y procedimientos(que puede ser, en la superficie de la tierra, o en yacimiento bajo la superficie),
 |
| Extracción de metales en yacimiento bajo la superficie |
 |
| Extracción de metales preciosos |
Muy raramente se encuentran metales en estado de pureza como para ser empleados industrialmente, pero con frecuencia se los halla en la mina combinados con otros cuerpo de composición muy variada y de éstos, los más comunes son: los óxidos, sulfuros, carbonatos, silicatos, sulfatos y los fosfatos.
Para obtener los metales debe efectuarse una serie de operaciones que consisten en extraer cuerpos extraños perjudiciales, llamados ganga, y graduar los que pueden contribuir a determinada propiedad particular. Para ello se los somete a la trituración, lavado, calcinación, fusión y afinación.
Trituración
Consiste en fragmentar el metal en trozos de diversos tamaños, por medio de machacadoras
mecánicas a mandíbula, molinos, etc.
 |
| Maquina de trituración de metales |
Lavado
Tiene por objeto la separación de los minerales por medio del agua en movimiento, con lo cual y de acuerdo con sus densidades, se depositan en el fondo o son arrastrados por las aguas. Este proceso es ayudado con mesas y cajas con cernidores de gran tamaño.
Molienda
El material extraído es nuevamente triturado y luego molido, obteniéndose así unos trocitos no mayores a 25 mm. A partir de allí, pasa a la denominada molienda húmeda, donde llega al tamaño menor de 1 mm siendo luego llevado a un separador magnético donde se adhiere la magnetita, rica en hierro y se elimina el resto.
 |
| Minero procediendo a la molienda |
Llevada la magnetita al molino de bolas, en circuito cerrado con clasificadores de hidrociclones, es reducida al tamaño de 44 micrones y que al hacerla pasar por seis separadores magnéticos, sucesivamente, se llega a obtener el 69% de hierro y un mínimo de 0.25% de fósforo. Este último puede ser reducido al 0.15% mediante flotación espumosa.
Para obtener los pellets la magnetita es introducida en tambores, donde se le adiciona un porcentaje de bentonita, como aglomerante, estos pellets, en forma de bolitas, son llevados a los hornos verticales donde son endurecidas a una temperatura de 1300° C. En este estado se los lleva a los altos hornos para la producción del arrabio.Teniendo en cuenta que la tecnología ha desarrollado procesos de reducción directa que eliminan el uso del alto horno, se está estudiando la aplicación de este nuevo procedimiento a una parte de la producción de pellets, así como también se prevee la posibilidad de producir aceros en la zona.
Calcinación
Se emplea para eliminar a baja temperatura los productos volátiles que no pueden ser separados con la trituración ni el lavado, para aumentar la porosidad y desecarlos. Este proceso es útil cuando los minerales deben ser transportados a los hornos a grande distancias, pues disminuye los gastos de transporte. Con el empleo de los grandes hornos, esta operación no es necesaria, ya que se verifica en su parte superior.
Fusión
Consiste en llevar el mineral a la temperatura de fusión, para que licuado permita extraer los
 |
| Producción de metales |
Afinación
Después de la fusión, hay ciertos metales como el cobre y el plomo, de los cuales aún no ha sido posible extraer toda la ganga. Se procede a fundirlos repetidas veces o a comprimirlos, proceso que denominado de afinación. Para la separación de la ganga del metal también se ha empleado el método de flotación, que consiste en introducir el mineral en recipientes de agua con un reactivo químico espumante. El mineral flota en la espuma y la ganga terrosa se moja y se sumerge, extrayéndose entonces de la parte superficial las partículas metalíferas. Este procedimiento es interesante por cuanto permite extraer metales de las menas en las que éste es escaso.
RECICLAJE
Cada día en todo el mundo, el ser humano genera millones de toneladas de basura. Sin
 |
| Reciclaje y reutilización de los metales |
Sin embargo, estos metales no siguen un patrón común a la hora de reciclarse. De ahí que sea importante separar el aluminio de aquellos materiales ferrosos como el hierro y el acero, ya que en muchos centros de reciclaje no se aceptan ambos tipos. Se pueden diferenciar de diversas maneras. La más fácil es a través de la etiqueta identificadora que la gran mayoría de los productos poseen. En caso de no tener dicha información, se podrá recurrir a un remedio más casero, como el de coger un imán. Todos aquellos materiales
que no se peguen querrán decir que son de aluminio.
Normalmente, en todas los países existen servicios y empresas de reciclaje que se encargan de su respectivo procesamiento. En estos lugares se informarán sobre los metales que se aceptan, así como de otras reglas a tener en cuenta para que su reciclaje sea óptimo. En otras ocasiones, existen también políticas locales, las cuales impulsan al ciudadano a comenzar a reciclar desde su propio hogar, recomendando la clasificación de basuras para depositarlas en cubos específicos.
Una vez que se sabe dónde, el siguiente paso será conocer cuáles son los materiales que podemos reciclar.
El acero
El acero, uno de los metales más utilizado en el mundo y también uno de los que más se han reciclado desde la antigüedad, se encuentra en nuestra vida cotidiana en muchos productos, como latas de comida, frigoríficos, motores o clavos. De hecho, el 40 por ciento de la chatarra de acero se destina a la producción de nuevos aceros, aunque sólo un pequeño porcentaje puede reciclarse como acero de envases. Cada envase producido contiene, aproximadamente, un 25 por ciento de acero reciclado.
En este sentido, si se recicla constantemente acero, se podrá no sólo aliviar la demanda de la minería, sino también ahorrar los recursos empleados en su producción, los cuales representan el cuádruple de gastos de energía y materia prima. Y es que, según estudios realizados en 2006, la chatarra reciclada disminuyó hasta el 40 por ciento de las necesidades mundiales de acero.
El aluminio
Otro de los metales que nos podemos encontrar en nuestro día a día y que es cien por cien
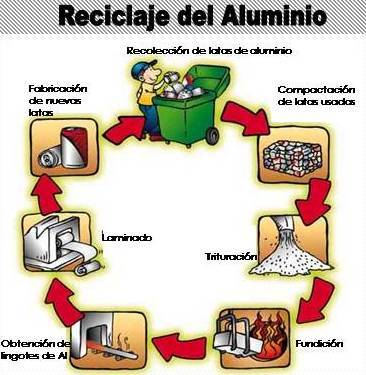 |
| Reciclaje del aluminio |
reciclable, es el aluminio. Latas de refrescos, recipientes, muebles de jardín o envolturas para preservar el chocolate son sólo algunos ejemplos que contienen este metal. Hoy en día, en Europa se recicla el 85 por ciento de las latas de bebidas. Los expertos aseguran que se salva suficiente energía reciclando una lata de aluminio como para hacer funcionar un televisor durante 3 horas y media. Sin embargo, del resto de productos, tan sólo se recupera el 42 por ciento del aluminio utilizado.
El cobre, bronce y latón
Junto al acero y el aluminio, existen otros metales como el cobre (utilizados para tuberías y cables), así como otros materiales genéricos como la joyería metálica, el bronce o el latón. Si bien es cierto que cualquiera de estos metales requiere bastante electricidad para volver a ser reutilizado, supone apenas el 5 por ciento del consumo energético que se necesitaría para producirlo desde las minas donde se extraen. Además, hay que tener en cuenta, que para la obtención de estos materiales se precisan materias primas limitadas como la piedra caliza o el carbón.
Lo que no se puede reciclar
Aunque casi la mayor parte de los metales se reciclan, existen algunos que no se pueden reutilizar. Tal es el caso de los contenedores usados para pinturas o productos tóxicos, tuberías (siempre y cuando no sean de cobre), ganchos de ropa y pedacería de metal.
Junto al acero y el aluminio, existen otros metales como el cobre (utilizados para tuberías y cables), así como otros materiales genéricos como la joyería metálica, el bronce o el latón. Si bien es cierto que cualquiera de estos metales requiere bastante electricidad para volver a ser reutilizado, supone apenas el 5 por ciento del consumo energético que se necesitaría para producirlo desde las minas donde se extraen. Además, hay que tener en cuenta, que para la obtención de estos materiales se precisan materias primas limitadas como la piedra caliza o el carbón.
Lo que no se puede reciclar
Aunque casi la mayor parte de los metales se reciclan, existen algunos que no se pueden reutilizar. Tal es el caso de los contenedores usados para pinturas o productos tóxicos, tuberías (siempre y cuando no sean de cobre), ganchos de ropa y pedacería de metal.
 |
| Vertedero de chatarra |
8.- Oxidación y corrosión
general que tienen los materiales a buscar su forma más estable o de menor energía interna. Siempre que la corrosión esté originada por una reacción electroquímica (oxidación), la velocidad a la que tiene lugar dependerá en alguna medida de la temperatura, de la salinidad del fluido en contacto con el metal y de las propiedades de los metales en cuestión. Otros materiales no metálicos también sufren corrosión mediante otros mecanismos.
Sin embargo, la corrosión es un fenómeno mucho más amplio que afecta a todos los materiales (metales, cerámicas, polímeros, etc.) y todos los ambientes (medios acuosos, atmósfera, alta temperatura, etc.).
Es un problema industrial importante, pues puede causar accidentes (ruptura de una pieza) y, además, representa un costo importante, ya que se calcula que cada pocos segundos se disuelve 5 toneladas de acero en el mundo, procedentes de unos cuantos nanómetros, invisibles en cada pieza pero que, multiplicados por la cantidad de acero que existe en el mundo, constituyen una cantidad importante.
Tipos de corrosión
Existen muchos mecanismos por los cuales se verifica la corrosión, que tal como se ha explicado anteriormente es fundamentalmente un proceso electroquímico.
Corrosión electroquímica o polarizada
La corrosión electroquímica se establece cuando en una misma superficie metálica ocurre una diferencia de potencial en zonas muy próximas entre sí en donde se establece una migración electrónica desde aquella en que se verifica el potencial de oxidación más elevado, llamado área anódica hacia aquella donde se verifica el potencial de oxidación (este término ha quedado obsoleto, actualmente se estipula como potencial de reducción) más bajo, llamado área catódica.
Corrosión por oxígeno
Este tipo de corrosión ocurre generalmente en superficies expuestas aloxígeno diatómico disuelto en agua o al aire, se ve favorecido por altas temperaturas y presión elevada ( ejemplo: calderas de vapor). La corrosión en las máquinas térmicas (calderas de vapor) representa una constante pérdida de rendimiento y vida útil de la instalación.
Corrosión microbiológica
Es uno de los tipos de corrosión electroquímica. Algunos microorganismos son capaces de causar corrosión en las superficies metálicas sumergidas. Se han identificado algunas especies hidrógeno dependientes que usan el hidrógeno disuelto del agua en sus procesos metabólicos provocando una diferencia de potencial del medio circundante. Su acción está asociada al pitting (picado) del oxígeno o la presencia de ácido sulfhídrico en el medio. En este caso se clasifican lasferrobacterias.
Corrosión por presiones parciales de oxígeno
El oxígeno presente en una tubería por ejemplo, está expuesto a diferentes presiones parciales del mismo. Es decir una superficie es más aireada que otra próxima a ella y se forma una pila. El área sujeta a menor aireación (menor presión parcial) actúa como ánodo y la que tiene mayor presencia de oxígeno (mayor presión) actúa como un cátodo y se establece la migración de electrones, formándose óxido en una y reduciéndose en la otra parte de la pila. Este tipo de corrosión es común en superficies muy irregulares donde se producen obturaciones de oxígeno.
Corrosión galvánica
Es la más común de todas y se establece cuando dos metales distintos entre sí actúan como ánodo uno de ellos y el otro como cátodo. Aquel que tenga elpotencial de reducción más negativo procederá como una oxidación y viceversa aquel metal o especie química que exhiba un potencial de reducción más positivo procederá como una reducción. Este par de metales constituye la llamada pila galvánica. En donde la especie que se oxida (ánodo) cede sus electrones y la especie que se reduce (cátodo) acepta los electrones.
Corrosión por actividad salina diferenciada
Este tipo de corrosión se verifica principalmente en calderas de vapor, en donde la superficie metálica expuesta a diferentes concentraciones salinas forman a ratos una pila galvánica en donde la superficie expuesta a la menor concentración salina se comporta como un ánodo.
Este tipo de corrosión se verifica principalmente en calderas de vapor, en donde la superficie metálica expuesta a diferentes concentraciones salinas forman a ratos una pila galvánica en donde la superficie expuesta a la menor concentración salina se comporta como un ánodo.
ceden electrones, y por tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox. Redox en términos generales es una abreviación de "reducción/oxidación", y se refiera a todas aquellas reacciones químicas en donde átomos cambian su estado de oxidación.
Siempre que ocurre una oxidación hay liberación de energía. Esta energía puede ser liberada de manera lenta, como es el caso de la oxidación o corrosión de los metales, o bien, puede ser liberada de forma muy rápida y explosiva como es el caso de la combustión.
La oxidación está presente en todos lados y la mayoría es a raíz del medio agresivo en que se encuentran, por ejemplo, ambientes de mar.
Tipos de Oxidación
1.Oxidación lenta: Ocurre casi siempre en los metales a causa del agua o aire, causando su corrosión y pérdida de brillo y otras propiedades características de los metales, desprendiendo cantidades de calor inapreciables; al fundir un metal se acelera la oxidación, pero el calor proviene principalmente de la fuente que derritió el metal y no del proceso químico (una excepción sería el aluminio en la soldadura autógena).
La oxidación puede ser lenta (un metal que se oxida)

2.Oxidación rápida: La que ocurre durante lo que ya sería la combustión, desprendiendo cantidades apreciables de calor, en forma de fuego, y ocurre principalmente en substancias que contienen carbono e hidrógeno.
Oxidación muy rápida y violenta (el fuego)

English vocabulary:
Bronce: bronze
Oro: gold
Plata: silver
Cobre: copper
Aluminio: aluminum
Hierro: iron
Oxidación: oxidation
Corrosión: corrosion
Reciclar: recycle
Acero: steel
Extracción: extraction
Producción: production
Pureza: purity
Aleaciones: Alloys
Enlace metálico: Metallic bond
Oro: gold
Plata: silver
Cobre: copper
Aluminio: aluminum
Hierro: iron
Oxidación: oxidation
Corrosión: corrosion
Reciclar: recycle
Acero: steel
Extracción: extraction
Producción: production
Pureza: purity
Aleaciones: Alloys
Enlace metálico: Metallic bond









For More...
ResponderEliminarsalwar suit manufacture in surat suit
Me han encantado todas las entradas del blog, especialmente las relacionadas con mecanizados de precision . Saludos
ResponderEliminarLos depósitos de poliéster son duraderos son perfectos para deposito agua para riego. Gracias a su firmeza y resistencia, y su escaso mantenimiento, estos recipientes garantizan una larga vida útil. Desde Poliéster Sur ofrecemos máxima calidad, seguridad y fiabilidad, con una garantía de 2 años. Si tu depósito sufre alguna rotura mecánica su reparación es sencilla ya que el poliéster es un material muy fácil de arreglar. Cubriremos cualquier problema que pueda presentarse tras la compra de tu depósito durante el periodo indicado.
ResponderEliminar